| Sprog : |
|
| Encyclopedia samfund |Encyclopedia Svar |Indsend spørgsmål |Ordforråd Viden |Upload viden |
Polyacrylamidgelelektroforese |
 |
|
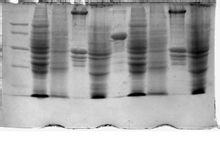
Kort introduktion Polyacrylamidgelelektroforese (engelsk: polyacrylamidgelelektroforese omhandlede PAGE) Rolle: til adskillelse af proteiner og oligonucleotider. Handling princip: polyacrylamidgel netstruktur med molekylsigte virkning. Det har to former: ikke-denaturerende polyacrylamidgelelektroforese (nativ PAGE) og SDS-polyacrylamidgel (SDS-PAGE), ikke-denaturerende polyacrylamidgel i elektroforese-processen, kan proteinet opretholdes komplet tilstand, og baseret på molekylvægten af proteinet, proteinet fastgjort til form og ladning størrelsen af gradienten gradvist adskilt.SDS-PAGE og kun forskellige afhængigt af proteinunderenheder af proteinet kan adskilles. Teknologien blev oprindeligt etableret i 1967 af Shapiro de finder i prøven mediet og acrylamidgel blev tilsat ionisk detergent og et stærkt reduktionsmiddel (SDS natriumdodecylsulfat er), den elektroforetiske mobilitet af proteinunderenheder afhænger primært af størrelsen af molekylvægten underenhed (ladefaktor kan ignoreres). Action SDS er en anionisk detergent, som denatureringsmidlet og solubilisering af reagenset, som kan bryde intramolekylære og intermolekylære hydrogenbindinger, molekylets at folde proteiner ødelægge den sekundære og tertiære struktur. Og stærkt reduktionsmiddel såsom mercaptoethanol kan dithiothreitol disulfidbindingerne mellem cystein rester fraktur. Prøven og tilsætte et reduktionsmiddel og SDS-gel, molekylet er en polypeptidkæde depolymerisering, aminosyre-sidekæder depolymeriserede i proteinbinding og SDS - SDS miceller negative ladninger langt overstiger mængden af ladning og nogle fibrinogen , således at eliminere forskellen i ladning mellem forskellige molekyler og strukturelle forskelle. SDS-PAGE anvendes generelt i diskontinuerlig puffer-system, sammenlignet med en kontinuerlig puffersystem, at have en højere opløsning. Rollen af koncentreret gel stabling interaktioner, gelen koncentrationen er lille, stor blændeåbning, mere fortynde prøven tilsættes til den koncentrerede gel efter migrering af store porer gel effekt blev koncentreret til en smal zone. Når prøvevæsken og en koncentreret gel valgt TRIS / HCI-buffer, elektrode opløsning valgt TRIS / glycin. Efter begyndelsen af elektroforese, HCI til chlorationer dissociation, en lille mængde af glycin, glycin dissociation ion. Protein med en negativ ladning, sammen med bevægelsen til den positive, hvor den hurtigste chlorid, glycin ion langsomste protein centreret. Elektroforetisk mobilitet begyndelsen maksimale chloridioner mere end protein, hvorved der dannes en lav ledningsevne region i ryggen, og den elektriske feltstyrke er omvendt proportional med lav ledeevne regionen, hvilket resulterer i en høj elektrisk feltstyrke, til proteinet bevæger sig hurtigt ioner og glycin, danner en stabil grænseflade, protein aggregater i nærheden af grænsefladen bevæger sig, koncentreret i et mellemliggende lag. Denne identifikationsmetode, mobilitet af proteinet afhænger af dens relative molekylmasse og elektrisk ladning og molekylære form med intet at gøre. Supplerende information Forkortet som polyacrylamidgelelektroforese PAGE (polyacrylamidgel elektroforese), polyacrylamidgel er et almindeligt anvendt som underlag elektroforese. Polyacrylamidgel monomererne acrylamid og methylen-bis-acrylamid polymerisation, en fri radikal-katalyseret polymerisationsproces. Catalyzed polymerisering Der er to almindelige metoder: kemisk polymerisation og fotopolymerisation. Kemisk polymerisation under anvendelse ammoniumpersulfat (AP) som katalysator, tetramethylethylendiamin (TEMED) som accelerator. Under polymerisationen, TEMED persulfat fri radikal katalysator, der fører til polymerisation af acrylamid monomer og methylen-bis-acrylamid og acrylamid produceret methylen kæder tværbinding, hvorved der dannes en tredimensional netstruktur. PAGE ifølge tilstedeværelsen eller fraværet af koncentreret virkning, er systemet opdelt i en kontinuerlig og diskontinuerlig systemet i to kategorier, kontinuerligt system elektroforese system, gel buffer pH og den samme koncentration af ladede partikler i det elektriske felt, hovedsagelig ved ladning og molekylsigte effekt. Diskontinuerlig puffersystem som ioniske komponenter, pH, koncentration og de potentielle gradient gel diskontinuiteter, ladede partikler i det elektriske felt effekt mobilitet er ikke blot en afgift, molekylsigte virkning, men også har koncentreret virkning, så adskillelsen strimmel definitionen og bedre opløsning end tidligere. Diskontinuerlig puffer består af en elektrode, stabelgel og adskillelse dannede gel. Koncentreret gelpolymerisering katalyseres af AP makroporøse gel, gelen buffer på pH6.7 Tris-HCI. Gelpolymerisering katalyseres af AP hullerne lim, gelpuffer af pH8.9 Tris-HCI. Løbebuffer var pH 8,3 Tris-glycin-puffer. To typer af porer gel, 2 buffer system, tre farver i pH-værdien for ikke at danne et kontinuerligt system af gelen porestørrelse, pH, ioniske sammensætning buffer diskontinuiteter, som er en væsentlig faktor i prøvekoncentration. Proces Protein elektroforese på polyacrylamidgeler, dens mobilitet og nettoladning afhænger af dens molekylære størrelse og form faktor. Hvis tilsætning af et reagens for at fjerne ladefaktoren, der afhænger af den elektroforetiske mobilitet molekylære størrelse, kan det bruges til bestemmelse af molekylvægt af protein elektroforese. 1967 Shapiro et al fandt, at det anioniske detergent natriumdodecylsulfat (SDS) har denne virkning. Når den sættes til proteinopløsningen og en tilstrækkelig mængde af SDS-mercaptoethanol, kan gendanne disulfidbindingerne i proteinmolekyler. Laurylsulfat som en negativ ladning, således at en række af protein-SDS-komplekser bringes på samme negativ ladningsdensitet, det er meget mere end mængden af afgift af det oprindelige protein og dækker således de forskellige typer af protein-protein-original ladning forskel, SDS og proteinbinding, kan forårsage en konformationsændring, protein-SDS kompleks dannelse minder om "cigar" form af den lange ovale bar, forskellige proteiner SDS kompleks som lilleaksen længde på ca 18A (1A negativ ti effekt = 10 m), såsom protein-SDS kompleks i gelen mobilitet, ikke længere er omfattet af proteinet af den oprindelige mængde og form af virkningen, og afhænger af den molekylære størrelse af protein-SDS-komplekser længde svarende til enheden med en afgift, de bevæger sig lige hastigheder fra koncentreret gel i gelen i gelen på grund af den molekylsigte effekten af polyacrylamid, kan små molekyler proteiner let bestemmes ved gel porestørrelse, resistens over for lille, hurtig migration makromolekylære proteiner er begrænset af modstanden er større hysterese proteiner under elektroforese så vil være baseret på størrelsen af deres respektive molekylvægte adskilles. SDS-polyacrylamidgelelektroforese, som kan anvendes til at bestemme molekylvægten af proteiner. Når molekylvægten mellem 15KD til 200KD protein mobilitet og logaritmen af molekylvægten lineære forhold svarende til formlen: logMW = K-BX formlen: MW er molekylvægten, X er mobilitet, k, b er konstant, kan hvis molekylvægten af standard proteiner med kendt mobilitet logaritmisk afbildning af molekylvægten, opnåede en standardkurve, ukendt protein elektroforese under de samme betingelser, i henhold til dens elektroforetisk mobilitet bestemmes fra standardkurven Vægt . SDS-polyacrylamidgelelektroforese er rensningsprocesser anvendes ofte i at teste renheden af det oprensede protein på SDS elektroforese normalt kun et bånd, men hvis proteinet er sammensat af forskellige underenheder, der kan dannes i den elektroforetiske svarende til de individuelle underenheder var flere bånd. SDS-polyacrylamidgelelektroforese, har høj følsomhed, kræver generelt mindre end størrelsesordenen mikrogram protein og ved elektroforese på molekylvægt kan opnås mens en sag, oplysninger for forståelsen og design af ukendt proteinoprensning proces er meget vigtig. Ofte stillede spørgsmål ⒈ med plastik elektroforese buffer system på effekt? I en diskontinuerlig SDS-PAGE elektroforese, gelen buffer, der anvender en Tris-HCI-buffer-system stabelgelen var pH6.7, gel pH8.9, elektroforese anvendte buffer var en Tris-glycin-buffer-system. I stabelgelen var pH sure miljø, så lille dissociation glycin, dens elektriske felt, svømning effektivitet er lav, mens meget høj ion CL, der er dannet mellem den nedre ledende zone proteinmolekyler i mellem mobilitet. Da den elektriske feltstyrke er omvendt proportional med ledningsevne, vil denne zone danne en høj spænding gradient, proteinmolekyler til at komme sammen krympning, koncentreret til en smal zone. Når prøven i adskillelsen gel, på grund af stigningen af gelen pH, alkalisk, glycin store dissociationshastighed øger mobiliteten, chloridion fulgte direkte efter gelen porestørrelse og på grund af reduktion i det elektriske felt, proteiner Ifølge deres iboende ladede molekyler og molekylære størrelse adskillelse. Derfor pH af hele reaktion systemet er afgørende for forsøget efter udelukkelsen af andre faktorer, er problemet stadig ikke er løst, skal det primære overvejelse af denne faktor, selvfølgelig, kan andre faktorer også vurderes fra forskellige aspekter. ⒉ prøve hvordan man skal håndtere? Ifølge prøve separation til forskellige formål, er der tre behandlingsmetoder: reducere SDS behandling, ikke-reducerende SDS behandling med et reducerende SDS alkyleringsproces. 1) reducerende SDS behandling: I prøvebuffer blev tilsat til SDS og DTT (eller β-mercaptoethanol), protein kropsbygning dissocieres, at afgiften neutraliseret form af SDS og protein kombination af molekyler i elektroforese, kun på molekylvægt adskillelse. Generel elektroforese ifølge håndteres på denne måde, den passende koncentration af prøveopløsning, tilføjer prøvepuffer, centrifugeret, og kogende vand 5min, og derefter centrifugeret pipettering. 2) med en reducerende SDS alkyleringsproces: iodeddikesyre alkylering af aminen kan være en god og holdbar robust beskyttelse SH-gruppe, til opnåelse af et smalt bånd, andre jod fange overskydende amin syre DTT, samtidig forhindre tekstur sølvfarvning fænomen. 100ul prøvepuffer 10 ul 20% af jod amin acetat, og inkuberet ved stuetemperatur i 30 minutter. 3) Ikke-reducerende SDS behandling: biologiske væsker, serum urea prøver, som regel med kun 1% SDS i kogende vand i 3min, ikke tilføje et reduktionsmiddel, og dermed proteinfoldning ikke er beskadiget, og ikke som en bestemmelse af molekylvægt at bruge. ⒊ SDS-PAGE gelelektroforese af de vigtigste komponenter i rollen? Polyacrylamid rolle: Acrylamid og give bæreprotein elektroforese, som er direkte relateret til størkning elektroforese succes med prokoagulant middel og miljø er nært beslægtede; Lim buffer: stabelgel Select pH6.7, gel valg pH8.9 Vælg tris-HCL-system, TEMED og AP: AP katalysatorer katalytisk enkelt og dobbelt C C polymeriseret i polyacrylamid. TEMED tetramethylethylendiamin, coagulant katalysator, katalytisk acceleration AP, natriumdodecylsulfat (SDS): anioniske detergenter, der er fire effekter: Anklagen til proteinet, dissociation af hydrogenbindinger mellem proteiner, Annuller intramolekylær hydrofobt protein, polypeptid at folde. ⒋ forbedre opløsningen ved SDS-PAGE måde? Fuldt polymeriseret polyacrylamid, kan forbedre opløsningen af gelen. Anbefalede praksis: at størknede ved stuetemperatur, kan gelen anvendes ved stuetemperatur i en periode. Der er udstyret med en bogey, der er placeret på et køleskab eller 4 grader, førstnævnte let føre til utilstrækkelig størkning, hvilket kan føre til SDS krystallisation. Generelle geler kan opbevares ved stuetemperatur 4 dage, kan SDS være hydrolyseret polyacrylamid. Almindeligt anvendt med Amido Sort, Coomassieblåt, sølvfarvning tre farvestoffer, forskellige farvestoffer og deres forskellige farvning metoder, specifik reference Guo Yao juni udarbejdet af "Protein elektroforese Teknisk Manual" P82-103. ⒌ "Smile" (på begge sider af den midterste tilt dent) form med fornuft? |
| Bruger Anmeldelse |
|
Ingen kommentarer endnu |