| Sprog : |
|
| Encyclopedia samfund |Encyclopedia Svar |Indsend spørgsmål |Ordforråd Viden |Upload viden |
Nitrat |
   |
|
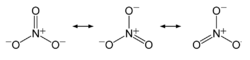
nitrat salpetersyre HNO3 danner salte. Metalionerne (ammoniumion) og forbindelsen af nitrationer, vigtigste er: natriumnitrat, kaliumnitrat, ammoniumnitrat, calciumnitrat, blynitrat, og ceriumnitrat. Kort introduktion Definition En metalion eller ammoniumion og nitrationer sammensætning af saltene.Indledning nitrat salpetersyre forbindelser afledt af det generiske navn. Nitrater er ioniske forbindelser indeholdende nitrationer NO3 (sænket) - (hævet). Og andre positive ioner, såsom ammoniumnitrat i NH4 (hævet) ioner. nitratsalte af salpetersyre HNO3. Metalionerne og nitrationer forbindelser vigtige er: natriumnitrat, kaliumnitrat, ammoniumnitrat, calciumnitrat, blynitrat, og ceriumnitrat. Såsom: AgNO3 (sølvioner og nitrationer), Zn (NO3) 2 (zinkioner og nitrationer) ...... er nitrater. NaNO3 (natriumioner og nitrat-ioner) eneste "nitrat" af et. Næsten alle nitrater opløseligt i vand, let opløseligt i vand alene ureanitrat, grundlæggende bismuthnitrat er uopløseligt i vand, så løsningen kan ikke være nitrat fleste andre kationer udfældes. Nitrat overflod i naturen, den vigtigste kilde til kvælstoffiksering Azotobacter dannet eller lufttemperaturen af lyn i den direkte syntese af kvælstof og ilt, kvælstofoxider, opløselig i vand til dannelse af salpetersyre i reaktionen med jorden mineral nitrat . Solid nitrater nedbrydes ved opvarmning afgiver oxygen, en af de mest livlige del af metalnitrater kun afgiver oxygen og blive nitrit, de fleste af de resterende metalnitrater, nedbrydning af metaloxider, oxygen og nitrogendioxid . Nitrat eller en sur vandig opløsning ved høj temperatur er en stærk oxidant, men i basisk eller neutral vandig opløsning næppe oxidation. Hovedformålet er, at planternes optagelse af kvælstof, at kvælstof er ikke kun den vigtigste komponent af protein aminosyrer, men også klorofyl syntese, øger fotosyntesen, nitrogen mangel Hvis planten gule blade. Natriumnitrat og calciumnitrat er en god kvælstofgødning. Kaliumnitrat er lavet krudt råvarer. Ammoniumnitrat kan anvendes som gødning, kan også være eksplosiv. Salpetersyre til det tilsvarende metal eller metaloxid i systemet. Indholdet af nitratforurening bør kontrolleres inden for et bestemt interval. Derfor bør befrugtning i dyrkning fokusere på væsentligt lavere nitrat indhold og adfærd, så klog befrugtning er nøglen til økologisk grønsagsproduktion i befrugtning proces bør have følgende kvalifikationer. Først, er den tunge organisk gødning organisk gødning ikke forårsager nitratforurening af grøntsager, hylde-stabil, god kvalitet. Dog bør organisk gødning til grøntsager fuldt nedbrudt. Gylle er uskadeligt kvalitet gødning, skadedyr administreres mindre hyppigt, reducere pesticidforbruget, forbedre vegetabilsk produktion, for at producere den bedste forurening-fri grøntsager. To vegetabilsk nitrat forvaltning ikke anvendt ammoniumnitrat, calciumnitrat og kaliumnitrat og andre nitrat gødning, let at gøre vegetabilsk akkumulere nitrater. Anvendelsen af ammonium bicarbonat, ammoniumsulfat, urinstof og andre gødningsstoffer, bør beløbet kontrolleres og dybe program barkflis kan reducere ophobning af nitrat i grøntsager. Tredje, på grund af høje temperaturer om sommeren og efteråret sæson befrugtning er ikke befordrende for akkumulering af nitrat til nitrogen kan være hensigtsmæssig. Lave temperaturer om vinteren og foråret, det svage lys, Nitratreductaseaktivitet faldet, let træt nitrat, ikke bør anvendes mindre kvælstof. Fjerde, på grund af den høje frugtbarhed befrugtning, jord rig på organisk humus, grøntsager let at akkumulere nitrater, bør kvælstof være forbudt. Fedtfattig vegetabilsk, grøntsager ophobes mindre nitrat, kvælstof og organisk gødning kan udbringes på jord frugtbarhed. Femte N gødning anvendt tidlige sætteplante Miaofei bedre befordrende grøntsager tidlig debut, lang hurtigt, reducere nitratindholdet. Seks er at kontrollere mængden af kvælstofgødning nitrat ophobning i grøntsager med mængden af gødning stiger. Derfor bør mængden af kvælstofgødning pr 667 kvadratmeter kontrolleres ved 15 kg kvælstof inden 2/3 som basal, 1/3 for Miaofei dyb ansøgning. Syv er ikke grønne løv kvælstof urea gødning så direkte kontakt med luft, ammoniumnitrat ion let blive absorberet af bladene, nitrat ophobning stiger, så bladgrøntsager bør ikke anvendes urea gødning. Otte er at kontrollere spildevand, spildevand udvaskning kunstvanding vand, spildevand indeholder store mængder tungmetaller, toksiner, bakterier og æg, etc., direkte forurenede grøntsager økologisk køkkenhave gødning. Struktur Nitrationer resonans med følgende formel: Nitrationer, hvor nitrogen-oxygen-binding mellem enkelt-og dobbeltbindinger mellem. Synthesis Salpetersyre med et metal, et metaloxid eller carbonat reaktion er den letteste fremgangsmåde til fremstilling af nitrat. Nitrater, såsom visse vandig Be (NO3) 2, Mg (NO3) 2 og Cu (NO3) 2 opvarmning hydrolyse derfor den tilsvarende vandfri nitrat. Vandfri nitrat kan opnås ved hjælp af følgende: N2O4 i flydende reaktion: Ni (CO) 4 N2O4 → Ni (NO3) 2 2NO 4CO I ren HNO3-N2O5 eller væske N2O5 reaktion: TiCl4 4N2O5 → Ti (NO3) 4 2N2O4 2Cl2 Med halogen nitrat reaktion ved lave temperaturer. Såsom klor nitrat ClNO3: TiCl4 4ClNO3? (-80 ℃) → Ti (NO3) 4 2Cl2 Nogle metaller kan også dannes med formlen Mox (NO3) y grundlæggende nitrater, som BiO (NO3) 2. De fleste nitrat ioniske krystaller, opløselig i vand. Nogle ikke-flygtigt salt. Nedbrydning Nitrat nedbrydningsprodukt kan være: Nitrit og ilt (alkalimetal-og jordalkalimetal nitrat); Metal og nitrogenoxider og ilt (mellem magnesium og kobber nitrat); Elemental metaller og oxider af kvælstof og ilt (efter kobber metal nitrat). Test Nitrat ioner i surt medium, vedtagelse og jern (II) reaktion på kvalitativ påvisning af brun ring. Se brun ring eksperimentet. Den samlede reaktion er: 3Fe2 NO3- 4H → 3Fe3 NO 2H2O |
| Bruger Anmeldelse |
|
Ingen kommentarer endnu |