| Sprog : |
|
| Encyclopedia samfund |Encyclopedia Svar |Indsend spørgsmål |Ordforråd Viden |Upload viden |
Halogenerede |
 |
|
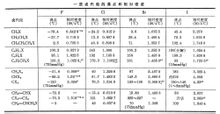
Kulbrintemolekyler brintatomer substitueret med et halogenatom af forbindelser kendt som CFC-gasser (halogenalkan), benævnt halocarboner. Et halogeneret carbonhydrid med formlen: (Ar) RX, kan X anses som en funktionel gruppe af halogenerede carbonhydrider, herunder F, Cl, Br, I. Navn Afhængigt af typen af substitueret halogen, fluorerede carbonhydrider, chlorerede carbonhydrider, carbonhydrid brom og iod-substitueret carbonhydrid kaldet, også i forhold til antallet af halogenatomet i molekylet er opdelt i en halogen, to halogenerede halocarboner og mere ; kan også opdeles efter forskellige mættet halogeneret kulbrinte, umættede halogenerede hydrocarboner og aromatiske halogenerede kulbrinter f.eks. Derudover bygger også direkte forbundet med halogen atom af kulstofatomer, opdelt i en halogeneret RCH2X, to og tre halogenerede halocarboner R2CHX R3CX.Nature Fysiske egenskaber Dybest set lignende kulbrinter, CH3F, CH3CH2F, CH3Cl, CH3CH2CL, CH3BR er en gas, mens resten er flydende lavt niveau, højt niveau fast. Kogepunkt, med kulstofatomer i molekylet, og det øgede antal halogenatomer (undtagen fluorcarboner) og halogen i atomnummer stiger steget. Tæthed med antallet af carbonatomer forøges. En hydrofluorcarbon, og en generelt lettere end vand, chlorerede carbonhydrider, carbonhydrid brom, iod og forskellige halogenerede kulbrinter tungere end vand. De fleste halogenerede uopløseligt eller meget lille opløselighed i vand, men opløseligt i mange organiske opløsningsmidler, og nogle kan anvendes direkte som et opløsningsmiddel. Halogenerede meste har en speciel lugt, mere generelt halogenerede flammehæmmende eller ikke-brændbart. Halogenerede alkyl ether helt vandfri Mg reagere med et Grignardreagens (RMgX), er reagenset et vigtigt mellemprodukt i organisk syntese, med CO2, CO og andre stoffer, genererer carboxylsyrer, aldehyder, ketoner og andre stoffer. Halogenalkoxy kan også reagere med Li til dannelse RLi. Kemiske egenskaber Halogenerede carbonhydrider er et vigtigt mellemprodukt i organisk syntese, mange syntetiske organiske materialer, kan det ske mange kemiske reaktioner, såsom substitutionsreaktion, eliminering reaktion [1] og så videre. Halogen, alkyl let-OH,-OR,-CN, NH3 eller substitueret H2NR, generere de tilsvarende alkoholer, ethere, nitriler, aminer og andre forbindelser. Generelle reaktion ligning kan skrives som: R ─ X : Nu ─ → R ─ Nu : X Iodider mest tilbøjelige til substitutionsreaktion, efterfulgt af alkylbromid, alkylchlorid og dels en arylgruppe, og et vinylhalogenid som kulstof - halogenbinding mere fast forbundet, svarende til reaktionen næppe forekommer. Halogenerede eliminering reaktion kan forekomme, virkningen af en base dehydrohalogenering danner kulstof - carbon-dobbeltbinding eller en carbon - carbon-tredobbelt binding, for eksempel, ethylbromid med en stærk base af kaliumhydroxid i ethanol, under de genererede betingelser af varme ethylen, kaliumbromid og vand. Halogenerede elimination reaktion Zaitsev regel at følge, når Chaykin. Undtagen o-dihalogenforbindelse kan være dehydrohalogenering reaktion, zink-støv (eller nikkelpulver) under dehalogenering reaktion kan også forekomme olefiner. Alifatiske halogenerede kulbrinter kan hydrolyseres i basisk vandig alkoholisk opløsning af et alkalisk alkohol eliminering reaktion alkenylaromatiske halogenerede kulbrinter er mere vanskelig. Forberedelse Simpel halogenerede carbonhydrider, såsom chlor (på vegne af), methylenchlorid, og mange flere er i høj temperatur eller lysforhold opstår direkte fra alkan metatesereaktion system. En halogeneret kulbrinte er mere kompleks struktur fra de tilsvarende alkoholer eller umættet carbonhydrid-system. Med henblik på en halogeneret kulbrinte, som regel med alkohol, kulbrinter fra systemet: (1) Fremstilling af en alkohol: den klassiske metode er almindeligt anvendt. De anvendte reagenser hydrogenhalogenidsyrer, fosfor halogenider og thionylchlorid (SOCl, også kendt som thionylchlorid). A. alkohol og hydrogenhalogenidsyrer: ROH HX === RX H2O Dette er en reversibel reaktion. At fuldføre reaktionen, søge at fjernes kontinuerligt fra reaktionsblandingen vand, kan udbyttet forbedres, for eksempel ved fremstilling af chlorerede carbonhydrider, blev brugen af tør hydrogenchloridgas passeret gennem tilstedeværelsen af vandfri zinkchlorid i alkohol, forberedelse bromerede carbonhydrider , og natriumbromid er en blanding af koncentreret svovlsyre med en alkohol med varme, forberedt iodohydrocarbon hvor alkoholen tilbagesvales sammen med hydrogeniodidsyre. Det er værd at nævne, at dette ikke er en god måde at syntetisere halogencarboner. Hovedsageligt fordi nogle alkohol vil forekomme under reaktionen omlejring, blandet produkt. B. alkoholer med fosfor halogenider virkning. Alkohol med fosfor halogenider virkning, kan fremstilles chlorerede kulbrinter, kulbrinte og iodohydrocarbon brom. Fremstilling af brom eller iod-substitueret carbonhydrid anvendte carbonhydrid phosphortribromid eller fosfor triiodid. For eksempel: 3C2H5OH PBr3 == 3C2H5Br P (OH) 3 3C4H9O HPI2 == 3C4H9I P (OH) 3 Phosphortrihalogenid anvendes med rødt phosphor og brom eller iod i alkohol sættes direkte til reaktionsblandingen. Udarbejdelse af chlorerede kulbrinter er generelt ikke anvendt phosphortrichlorid, ofte på grund af udbyttet genererede phosphit efterlader kun nå op på omkring 50%: 3ROH PCl3 == P (OR) 3 3 HCI Derfor er den generelle anvendelse af phosphorpentachlorid med alkohol fra reaktionen af chlorerede carbonhydrider. ROH PCl5 == RCL POCl3 HCI C. alkohol med thionylchlorid (SOCl) effekt. Dette er den mest almindeligt anvendte chlorerede carbonhydrider fremstillingsmetoder. ROH SOCl2 = RCL SO2 HCl Reaktionsbiprodukter er gasser, let at fjerne, så høj renhed, udbytte på omkring 90%. Industriproduktionen er også mere brug af denne metode. |
| Bruger Anmeldelse |
|
Ingen kommentarer endnu |