| Sprog : |
|
| Encyclopedia samfund |Encyclopedia Svar |Indsend spørgsmål |Ordforråd Viden |Upload viden |
Avogadros lov |
 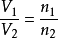 |
|
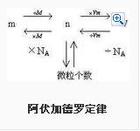
Avogadros lov (Avogadros hypotese) samme temperatur og tryk, det samme volumen af enhver gas, der indeholder det samme antal molekyler, kaldet Avogadros lov. Er mængden af gasmolekylerne indeholdt i rummet besat under normale forhold, den gennemsnitlige afstand mellem gasmolekylerne er omkring 10 gange diameteren af molekylerne, således at bestemme antallet af molekyler indeholdt i gassen, er gassen hovedsageligt bestemt af volumenet af intermolekylære Den gennemsnitlige afstand end størrelsen af molekylet.Definition Ved den samme temperatur og tryk. Det samme volumen af enhver gas, som indeholder det samme antal molekyler Såkaldte fire med loven, også kaldet fem forskellige love (fem med henvisning til den samme temperatur og det samme tryk, den samme volumen, det samme antal molekyler, den samme mængde stof). Brug af Object Gas, kan være en enkelt gas kan være blandet gas. Gas kan være et enkelt stof, kan det være sammensatte gas. Inferens Lov (1) samme temperatur og tryk, (2) Når den samme temperatur med det samme volumen, (3) den samme temperatur og tryk, såsom kvalitet, (4) Når den samme temperatur og tryk, M1/M2 = ρ1/ρ2 Den gennemsnitlige afstand mellem molekyler besluttede også på ydersiden temperatur og tryk, temperatur, det samme tryk, enhver gas molekyler næsten lig med den gennemsnitlige afstand mellem (svag indsats mellem gasmolekyler, kan ignoreres), så lov. Loven angiver en gas, der deltager i den kemiske reaktion Formula udlede ukendte gas, osv. Der er en bred vifte af applikationer. Avogadros lov at: i den samme temperatur og tryk, der indeholder den samme mængde gas det samme antal molekyler. 1811 af den italienske kemiker Avogadro foreslåede hypotese blev senere anerkendt af det videnskabelige samfund. Denne lov viser forholdet mellem volumen af reaktionen gas at illustrere sammensætningen af gasmolekylerne, gasdensiteten bestemmelse af molekylvægten af gasformige forudsat stoffer. For etablering af atomer og molekyler til at sige, men også spillet en positiv rolle. Ligning Clapeyrons ligning, også kendt som "idealgasligningen." High school kemi, Avogadros lov indtager en meget vigtig position. Det er almindeligt anvendt, især i formel Beregning gasformige stoffer, molekylvægt, hvis de anvendes korrekt, er problemet let at løse. Herunder er en kort par ligninger stammer ifølge kt Timberland relationer i for bedre at forstå og bruge Avogadros lov. Clapeyrons ligning udtrykkes normalt ved følgende formel: PV = nRT ...... ① P er tryk, V er den gasmængde, n betegner den mængde stof, T er den absolutte temperatur, R er gaskonstanten. Alle gas R værdier er de samme. Hvis trykket, temperatur og volumen anvendes international enhed (SI), R = 8,31 Pa · m 3 / mol · åben. Hvis trykket er det atmosfæriske tryk, volumen er op, så R = 0,082 atm · l / mol · deg. Fordi n = m / M, ρ = m / v (n-i stof, m-massen M-molarmasse, værdien svarende til molekylvægtene, ρ massefylde gasformige stoffer), så Ke Lapei Lang ligning kan også skrives i to former: Pv = MRT / M ...... ② og PM = ρRT ...... ③ I A, B to gas diskussion. (1) I samme T, P, V Time: Ifølge ① typen: nA = nB (dvs. Avogadros lov) MW skal Det molære masse ratio = massefylde ratio = vægtfylde). Hvis mA = mB derefter MA = MB. (2) T · P på samme tid: = Molvægt forholdet mellem volumenet af den inverse, to gasser = molforhold af størrelsen af den inverse masse) Mængden af stof i omvendt ratio = gas tæthed; to gasmængden ratio = gasdensitet er omvendt proportional). (3) T · V på samme tid: To gastryk af gassen molekylvægt ratio = molmasse = omvendt proportional). Lov inferens |
| Bruger Anmeldelse | Alle Anmeldelse [ 1 ]>>> |
| ||||