| Sprog : |
|
| Encyclopedia samfund |Encyclopedia Svar |Indsend spørgsmål |Ordforråd Viden |Upload viden |
Coulometrisk titrering |
     |
|
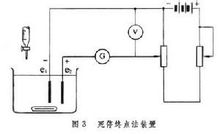
Også kendt som den konstante strøm coulometrisk titrering metode er baseret på den styrede strøm elektrolyse proces baseret på coulometri. Princip Med styrken af en bestemt konstant strøm gennem den elektrolytiske celle, mens elektrisk klokke optagetiden. Da elektroden reaktion i nærheden af den arbejdende elektrode fortsætte med at producere et stof, som i opløsning reagerer med teststoffet. Når teststoffet er "titrering" (reaktion) er gjort, ved udgangen af reaktionen måleapparatet signalerede straks stoppe elektrolyse, slukke for elektriske ur. Ifølge Faradays lov, jeg ved elektrolyse tidspunkt t, og strømstyrken beregne massen af prøveopløsning W:Hvor: Q er den magt forbruges af elektroden reaktion (Q = I · t) Μ er den molære masse af prøvestof, n er antallet af elektron transfer elektrode reaktion. F er Faradays konstant (værdien 96485C/mol) [1] Udstyr Coulometrisk titrering enhed er en konstant strøm elektrolyse apparatet (fig. 1, е elektroden). Strømmen gennem elektrolytisk celle ved præcision galvanometer G viser, men også af præcision potentiometer modstand spænding målestandarder og søge. Elektrolytisk celle har to par elektroder (2), en ende af elektroden par er angivet; andet par måleelektroder Coulomb, som reagerer med stoffet, der skal måles fra arbejdselektroden, elektroden, og den anden nævnte ekstra elektrode. For at forhindre indbyrdes interferens mellem de to elektroder, er den ekstra elektrode typisk monteret i et glas omfattende, omkranset af en porøs bund af huset basen oven agarlag eller silikone eller ærme lukket af ionbyttermembranen at forhindre ioner ud . Hvor kan angive generelle el ved titrering, kan coulometriske titrering anvendes til at angive slutningen. Angiver afslutningen af metoden Indikator metode Bestemmelse af hydrazin, for eksempel en elektrolytisk celle med hydrazin og en masse kaliumbromid, methylorange som indikator elektrode reaktion er: Cathode: 2H 2 e ─ → H2 anode: 2Br-─ → Br2 2 e Br2 og elektroden resulterende fra reaktionen af en hydrazin opløsning: NH2-NH2 2 Br2 ─ → N2 4 HBr Overdreven oxidation af Br2 vil gøre det falme indikator, der angiver slutningen. Stop elektrolyse, nuværende og tid beregninger fra opløsningen af hydrazin indhold. Potentiometrisk bestemmelse af koncentrationen af den sure opløsning ved hjælp af en glaselektrode og en kalomelelektrode som indikator elektrode pH-meteret viser enden. Meget negativ platin arbejder elektrode, sølv er yderst ekstra elektrode. Elektrode reaktion er: Cathode: 2H 2 e ─ → H2 Negativ: 2AG 2 Cl-─ → 2AgCl 2 e Som elektrolyse provenuet bliver surheden af løsningen reduceret. Af pH med en pH-meteret viser en pludselig stigning i slutningen. Dette princip kan bestemmes ved hjælp af fremgangsmåden ifølge referencematerialet og Kaliumhydrogenphthalat renhed, et par procent præcision. Fastanslag endepunkt metoden Med to platinelektroder (figur 3) E1, E2 som indikator elektrode. I ovenstående plus en lille spænding (50 mV eller lidt større) og linjen i serie et følsomt galvanometer G. At gøre strømmen gennem den elektrolytiske celle, skal en platinelektrode reduktionsreaktion forekomme, anden platinelektrode oxidationsreaktion forekommer. Hvis opløsningen på samme tid er der en redox reversibel redox oxidation og reducerede tilstande (såsom Fe3 og Fe2 , Br2 og Br-), dets polarografisk kurve vist i figur 4a, blot tilføje en lille spænding AE, kan gøre oxidationstrinnet er genoprettet på E1, E2 på oxidations-reduktions tilstand, strøm gennem den elektrolytiske celle. Hvis opløsningen i tilstedeværelse af oxiderede og reducerede stater ikke tilhører den samme strøm lige på den del af to [såsom H og As (Ⅲ)], så når polarografisk kurve vist i figur 4b. At gøre strømmen gennem den elektrolytiske celle i figur 3, er en forholdsvis stor spænding påkrævet. Hvis tilsat til en opløsning af 3 As (Ⅲ) og natriumbromid, og derefter titreres med en opløsning af brom As (Ⅲ). I løsningen før ækvivalenspunktet og ikke blot Br-Br2, behøver vende parterne ikke eksisterer, når den påtrykte spænding på 50 mV, således at strømmen gennem den elektrolytiske celle er ikke. Lige over titrering slutpunkt, både Br-der Br2 opløsningen, den anvendte spænding er lille, er der elektrolyse opstår galvanometret viser forudindtaget part angiver titrering slutpunkt. Selv om denne løsning under titreringen As (Ⅲ) og As (Ⅴ), men under de eksperimentelle betingelser, de to er ikke reversible elektrisk højre, så kan ikke spille rollen som reversible redox par. Brug af fastanslag coulometrisk titrering endpoint metode angiver slutningen af eksempel er at bruge elektrolyse til at producere Br2 titrering Som (Ⅲ). Så Coulomb elektrolytisk celle er de to arbejdsgrupper elektroder af platin elektroder. Indeholdende As (Ⅲ) blev tilsat svovlsyre og natriumbromid, elektroden reaktion er: Cathode: 2H 2 e ─ → H2 Positiv: 2Br-─ → Br2 e To indikator elektroder E1, E2 og kredsløb vist i figur 3. Platin er produceret ved elektrolyse Br2 niveau titreringsopløsningen As (Ⅲ). Galvanometeret G angive slutningen. Status quo Coulometrisk titrering er den mest nøjagtige metode til konstant analyse, men også en meget følsom metode til bestemmelse af sporbestanddele. På grund af den tid, og strømmen kan måles nøjagtigt, coulometriske titrering er meget høj præcision, er præcisionen af bestemmelsen af den konstante komponent forventes nået to meget få. Denne metode kan anvendes på situationer, hvor sammenlignet med den generelle kapacitetsanalyse er overlegen. Det behøver ikke at forberede standardløsninger, og derfor er der ingen standard løsning stabilitetsproblemer. Det måler ikke volumen, der var ingen fejl i denne henseende. Det er mere sandsynligt end den generelle konstanter automation. I Coulomb elektrolysecellen er titrant genereres ved elektrolyse: H , OH-, Cl2, Br2, I2, Ce (Ⅳ), Ti (Ⅲ), Fe (Ⅱ), Mn (Ⅱ), Ag (Ⅰ) Fe (CN) Shi, Fe (CN) Wang, CuBr underholdning, Sn (Ⅱ) og så videre. De kan titrering mange uorganiske og organiske stoffer. Coulometrisk titrering analyse af de bedst egnede til anvendelse som den grundlæggende standard volumetriske analyse af kemiske reagenser. |
| Bruger Anmeldelse |
|
Ingen kommentarer endnu |